NEWS & EVENTS
新聞動態 —
文|源 謝小寒
我國現行《專利法》于1985年開始施行,曾分別于1992年、2000年、2008年進行過三次修改。2020年10月17日,《全國人民代表大會常務委員會關于修改<中華人民共和國專利法>的決定》由中華人民共和國第十三屆全國人民代表大會常務委員會第二十二次會議通過,自2021年6月1日起施行。本次修改是《專利法》經歷的第四次修改,其中涉及藥品專利保護期補償和藥品專利鏈接。本文主要針對這兩個問題展開討論。
01
關于藥品專利保護期補償
根據修改后《專利法》第四十二條第三款的規定,為補償新藥上市審評審批占用的時間,對在中國獲得上市許可的新藥發明專利,國務院專利行政部門可以應專利權人的請求給予期限補償。補償期限不超過五年,新藥上市后總有效專利權期限不超過十四年。
該藥品專利期限補償制度的主要意義在于為有價值的創新藥專利提供保護期補償,鼓勵創新藥研發。
藥品上市前所必須進行的藥品注冊是一個復雜的過程。根據擬申請上市藥品種類的不同,藥品注冊申請人需要進行相應的試驗,以獲得充足的數據來證明藥品是安全、有效、質量可控的。這些試驗不僅需要花費大量的金錢,還需要耗費很長的時間。與此同時,藥品審批部門對于注冊申請人提交的數據,還需要進行審查,這也是需要一定時間的。但是專利權是有期限的,藥品專利通常是發明專利,保護期限為自申請日起20年。因此,為通過藥品注冊程序進行試驗以及藥品審批部門審查所耗費的時間,均可能占用該藥品所實際享有的專利保護期。
為了補償專利藥因為注冊程序而損耗的專利保護期,美國、歐盟、日本、韓國等均建立了藥品專利保護期限延長制度,從而避免因注冊程序而使專利藥的“有效專利保護期”縮短。盡管各國藥品專利保護期補償制度的具體內容和實施方式存在差異,但是都旨在補償藥品專利權人在獲得藥品上市行政許可中損失的保護期,以確保創新藥企獲得與其新藥研發投入相匹配的盈利,確保其研發投資獲得合理的回報,從而鼓勵藥企對創新藥的持續研發。下表對不同國家的藥品專利保護期補償制度的異同進行了比較。
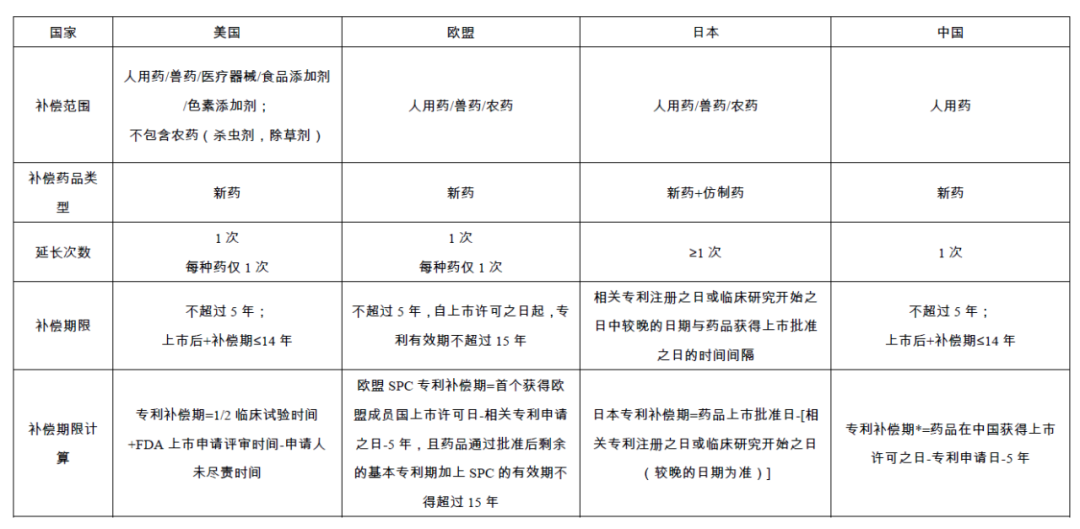
專利補償期限的長短直接影響新藥專利權人合法占有相關市場周期的長短,尤其是對于藥效好,市場認可且成熟度較高的藥品。另一方面,對于仿制藥廠家而言,專利補償期限越長,其仿制藥上市時間就越遲。因此,專利補償期限的長短也直接關乎仿制藥廠家的經濟利益。
2020年11月27日,國家知識產權局公開發布《專利法實施細則修改建議(征求意見稿)》(以下簡稱實施細則修改建議),該實施細則修改建議在專利法的框架下詳盡規定了專利期限補償時間的計算方式、保護范圍、提出申請的時機、申請條件、期限補償無效宣告程序等。依照實施細則修改建議,我國的藥品專利期限補償的主要規則如下:
實施細則修改建議中專利期限補償時間的計算方法與歐盟現行的計算方式基本相同。采用這種相對簡單的計算方式似乎是出于有利于整個制度的推進與施行的考慮。另一方面,專利法中規定的上市后總有效專利期限的上限則與美國相同,相對于歐盟減少了1年。筆者認為,專利期限補償時間的計算方式關系到新藥與仿制藥廠家的各方利益,應立足于我國基本國情,平衡各方利益。
02
關于藥品專利鏈接制度
藥品專利鏈接制度是指仿制藥上市批準與創新藥品專利期滿相“鏈接”,即仿制藥注冊申請應當考慮先前已上市藥品的專利狀況,避免可能的專利侵權糾紛。藥品專利鏈接制度有兩層含義:一是仿制藥的上市申請審批與相應的藥物專利有效性審核的程序鏈接;二是國家藥品監督管理局與知識產權局的職能鏈接。
藥品專利鏈接制度最早起源于美國1984年的Hatch-Waxman法案。在該法案的框架下,美國構建了以專利保護期補償、數據保護期、橙皮書、Bolar例外、仿制藥簡化申請(ANDA)、30個月遏制期、首仿藥的180天市場獨占期等為核心的藥品專利鏈接體系。藥品專利鏈接制度的實施,一方面可以鼓勵仿制藥企業在上市申請審批結束前解決專利糾紛問題,降低藥品上市后的訴訟風險;另一方面,也使得藥品上市申請的審批過程公開、透明,有利于業界正確評估藥品的侵權風險,避免不必要的糾紛。
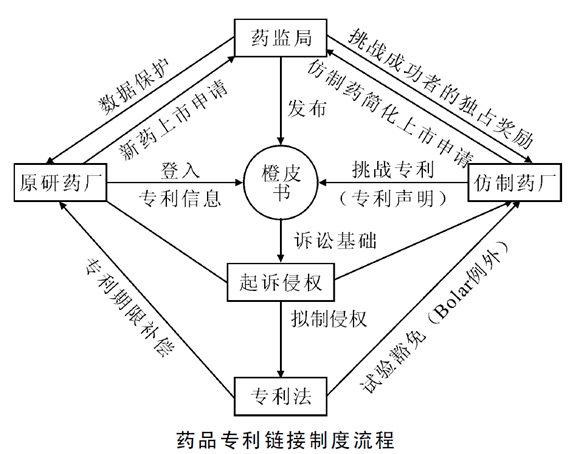
我國在2008年修改《專利法》時正式引入了“Bolar例外制度”,即,為提供行政審批所需要的信息,制造、使用、進口專利藥品或者專利醫療器械的,以及專門為其制造、進口專利藥品或者專利醫療器械的,不視為侵犯專利權。
在美國,藥品專利保護期限補償制度是作為Bolar例外的配套制度而建立的,其制度設計的目的在于使得專利權人利益和社會公共利益之間相對平衡。我國在2008年專利法中引入的Bolar例外顯然有利于促進我國仿制藥行業的發展,而隨著我國經濟的快速發展以及科技創新能力的提升,客觀上要求給予我國醫藥企業更多的創新發展空間,需要在制度上給予自主創新更多的支持。在此次《專利法》第四次修改中引入了藥品專利保護期限補償制度,使得在新形勢下更有利于實現創新藥企與仿制藥企業之間利益的相對平衡。
同時,此次《專利法》第四次修改也引入了藥品專利鏈接制度(新增的第七十六條)。
第七十六條 藥品上市審評審批過程中,藥品上市許可申請人與有關專利權人或者利害關系人,因申請注冊的藥品相關的專利權產生糾紛的,相關當事人可以向人民法院起訴,請求就申請注冊的藥品相關技術方案是否落入他人藥品專利權保護范圍作出判決。國務院藥品監督管理部門在規定的期限內,可以根據人民法院生效裁判作出是否暫停批準相關藥品上市的決定。
藥品上市許可申請人與有關專利權人或者利害關系人也可以就申請注冊的藥品相關的專利權糾紛,向國務院專利行政部門請求行政裁決。
國務院藥品監督管理部門會同國務院專利行政部門制定藥品上市許可審批與藥品上市許可申請階段專利權糾紛解決的具體銜接辦法,報國務院同意后實施。
該條款具體規定了在藥品上市許可審批階段,原研藥廠和仿制藥廠之間的專利權糾紛解決辦法,即,可通過向人民法院起訴(司法途徑)或向專利行政部門請求行政裁決(行政途徑)解決糾紛。
關于受理藥品注冊申請后發生專利糾紛的處理,各國有不同的處理方式。
在美國,專利權人可以向法院提出專利侵權訴訟,在最長30個月的訴訟期間(遏制期),藥品審批部門不得最終批準仿制藥的注冊申請。
在歐盟,藥品審批部門不進行任何處理,由相關當事人通過司法途徑解決。
在中國,專利糾紛由專利行政部門或者人民法院解決。對于當事人來說,這兩種糾紛解決途徑各有優點。因此,同時設定法律訴訟與行政裁決兩種保護機制不失為一種便于當事人的制度。綜上,對于專利糾紛的解決,藥品審批部門都不參與其中,司法途徑是中、美、歐的共同選擇。
關于司法判決或者行政裁決的提起及其結果是否影響藥品注冊進程及結果,中、美、歐的處理方式也存在不同。歐盟的做法最為簡單,完全不考慮專利糾紛;美國會因專利糾紛而影響藥品注冊結果;中國在本次《專利法》修改中明確規定了,國務院藥品監督管理部門在規定的期限內,可以根據人民法院生效裁判作出是否暫停批準相關藥品上市的決定。
為了形成關于專利鏈接制度的更為完整的框架,我國還出臺了一些配套措施。2020年9月11日由藥監局、知識產權局公布的《藥品專利糾紛早期解決機制實施辦法(試行)(征求意見稿)》(下稱“實施辦法征求意見稿”)以及2020年10月30日公布的最高人民法院《關于審理涉藥品上市審評審批專利民事案件適用法律若干問題的規定》(征求意見稿),對藥品專利糾紛早期解決機制進行了細化和延伸,主要包括以下幾個方面:
1.建立中國上市藥品專利信息登記平臺
國務院藥品監督管理部門建立中國上市藥品專利信息登記平臺(相當于美國制度中的橙皮書),供藥品上市許可持有人登記在中國上市藥品的核心專利相關信息并向社會公示,作為仿制藥申請人提供專利權屬狀態聲明的依據。未在中國上市藥品專利信息登記平臺登記的專利信息,不適用該辦法。
在中國上市藥品專利信息登記平臺中登記的藥品專利可以是:化學藥品的藥物活性成分化合物專利、含活性成分的藥物組合物專利、醫藥用途專利;生物制品的序列結構專利;中藥的中藥組合物專利、中藥提取物專利、醫藥用途專利。
2.專利聲明
化學仿制藥申請人提交藥品上市許可申請時,應當對照已在中國上市藥品專利信息登記平臺載明的專利信息,針對被仿制藥每一件相關的藥品專利作出聲明,并提供聲明依據。聲明分為四類:
一類聲明:中國上市藥品專利信息登記平臺中沒有被仿制藥品相關專利信息;
二類聲明:中國上市藥品專利信息登記平臺收錄的被仿制藥品的相關專利已終止或者被宣告無效;
三類聲明:中國上市藥品專利信息登記平臺收錄有被仿制藥品相關專利,仿制藥申請人承諾在專利有效期屆滿之前所申請的仿制藥暫不上市;
四類聲明:中國上市藥品專利信息登記平臺收錄的被仿制藥相關專利權應當被宣告無效,或者其仿制藥未落入相關專利權保護范圍。
專利權人或者利害關系人對仿制藥申請人的專利聲明、聲明依據存在異議的,可以自仿制藥上市許可申請公示之日起45日內,就申請上市藥品的相關技術方案是否落入相關專利權保護范圍向人民法院提起訴訟或者向國務院專利行政部門申請行政裁決。
3.對化學藥品設置審評審批等待期
國務院藥品監督管理部門根據化學仿制藥申請人提出的專利狀態聲明類型,對藥品審評審批實施分類處理。
對提交第一類、第二類聲明的,依據技術審評結論作出是否批準上市的決定;對提交第三類聲明、技術審評通過的,作出批準上市決定,同時注明應當在專利權期限屆滿后方可上市銷售。
對提交第四類聲明的,如專利權人或者利害關系人自國家藥品審評機構公示藥品上市許可申請之日起45日內,就申請上市藥品的相關技術方案是否落入相關專利權保護范圍向人民法院提起訴訟或者向國務院專利行政部門申請行政裁決,則自人民法院或者國務院專利行政部門立案或者受理之日起,國務院藥品監督管理部門對化學仿制藥注冊申請設置9個月的等待期(相當于美國制度中的遏制期),等待期內國家藥品審評機構不停止技術審評。技術審評通過的,國務院藥品監督管理部門還需結合人民法院判決或者國務院專利行政部門行政裁決作出相應處理。
4.首仿藥的市場獨占期
為鼓勵仿制藥高質量發展,對首個挑戰專利成功且首個獲批上市的化學仿制藥申請人給予市場獨占期,國務院藥品監督管理部門在12個月內不再批準同品種仿制藥上市,但市場獨占期不超過被挑戰藥品的專利權期限。
值得注意的是,各國設置的遏制期不同:美國的遏制期長達30個月,加拿大是24個月,韓國是9個月,我國在實施辦法征求意見稿中設置的等待期是9個月。筆者認為,等待期時長應該與我國平均的專利侵權訴訟周期相適應。如果設置時間過短,則國務院藥品監督管理部門依然無法按照人民法院生效判決或者國務院專利行政部門行政裁決作出處理,設立批準等待期的目的也無法達到;如果設置時間過長,則有可能會不必要地妨礙仿制藥的上市。
各國設置的首仿藥市場獨占期也不同:美國提供了180天的市場獨占期,加拿大沒有獨占期,韓國是9個月,我國在實施辦法征求意見稿中設置的獨占期是12個月。這一較長的市場獨占期會起到鼓勵仿制藥廠商對原研藥專利進行挑戰的作用。
如上所述,實施辦法征求意見稿已對我國藥品專利鏈接的具體實際操作提出了諸多建議,但其內容必然還會在理論和實務界引起進一步的討論。
上述一系列法律法規的相繼出臺充分體現了我國立法者希望全面推進藥品專利鏈接制度,實現權利人利益和公共利益的適當平衡的目標,以及對國外藥品專利鏈接制度的借鑒。相信隨著各界對藥品專利鏈接制度認識的不斷深入,相關制度在實踐中的不斷完善和細化,我國的藥品專利鏈接制度會形成更為完整的框架。
-
馬秋娟,楊倩等,《各國藥品專利期限補償制度的比較研究》,中國新藥雜志,2018年第27卷第24期 -
張鸝,《一分鐘看懂:專利鏈接的前世今生》,2018年1月21日 -
俞風雷,《知識產權保護中的利益平衡理論及其制度構建—以我國藥品專利鏈接制度為例》,求索雜志,2019年第6期 -
劉依檬,《藥品專利鏈接制度域外實踐與本土探索》,科技創業月刊,2019年第5期 -
杜澄杰,《論藥品專利鏈接制度在我國的推行與完善》,西南知識產權評論,2020年第2期 -
練茂榮,《藥品專利保護期限的延長——及與Bolar例外之間的利益平衡》,西南政法大學碩士學位論文,2014年3月1日
掃二維碼用手機看

地址:北京市海淀區學院路30號科大天工大廈B座16層
郵編:100083
電話:010-8231-1199
郵箱:mail@peksung.com

- 關注北翔知識產權 -
北京北翔知識產權代理有限公司
免責聲明 在本網站中發布信息均僅供參考,不構成任何法律建議或意見,亦不應被用作上述目的。委托事宜以即時咨詢北京北翔知識產權代理有限公司而獲得的反饋意見為準。
